La stretta interazione tra cellule del tessuto osseo e cellule della linea ematopoietica svolge un ruolo chiave nel mantenimento dell’omeostasi dello scheletro (1). Le cellule osteogeniche, derivanti dalle cellule staminali mesenchimali, sono regolatori della nicchia ematopoietica e influenzano le cellule mieloidi e linfoidi, e il loro commitment. Le cellule mieloidi, invece, possono differenziare in osteoclasti e interagire con le cellule osteogeniche nel rimodellamento osseo (2-4). Disordini specifici nel metabolismo energetico di queste popolazioni cellulari determina uno squilibrio nell’omeostasi scheletrica, causando lo sviluppo di patologie ossee (5). Nonostante il complesso macchinario di comunicazione cellula-cellula tra cellule osteogeniche e osteoclasti sia stato molto studiato, la loro regolazione metabolica deve essere ancora caratterizzata in dettaglio. Recentemente (6-8) è emerso come i mitocondri abbiano un ruolo chiave nel mantenimento dell’omeostasi cellulare anche nel microambiente osseo.
Il lavoro di Ding e colleghi, pubblicato su Nature Communication, indaga come i mitocondri delle cellule osteogeniche possano influenzare la funzione osteoclastica e il riassorbimento osseo valutandone poi le implicazioni in patologie scheletriche, come l’osteoporosi.
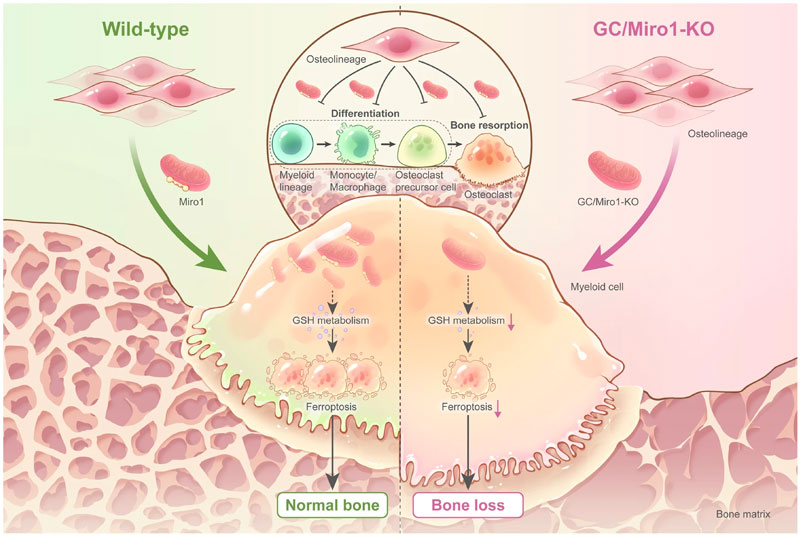
Attraverso l’utilizzo di modelli animali in cui i mitocondri sono marcati con delle molecole reporter esclusivamente nelle cellule della linea osteogenica (osteoblasti e osteociti), è stato dimostrato che le cellule osteogeniche sono in grado di trasferire i mitocondri in modo preferenziale alle cellule mieloidi (monociti/macrofagi). Per valutare l’effetto del trasferimento dei mitocondri agli osteoclasti, saggi in vitro hanno dimostrato come il contatto diretto dei precursori degli osteoclasti con gli osteoblasti riduce il differenziamento delle cellule mieloidi in cellule mature. Al contrario, quando i precursori degli osteoclasti sono indirettamente sottoposti all’influenza delle cellule osteogeniche, il loro differenziamento è aumentato, dimostrando come il trasferimento dei mitocondri inibisca il commitment delle cellule mieloidi in osteoclasti.
Poiché è noto che la proteina MIRO1, una GTPasi legante il calcio, abbia un ruolo chiave nel trasporto dei mitocondri (9), gli autori hanno dimostrato che questa proteina anche nel tessuto osseo è responsabile del trasferimento dei mitocondri dalle cellule osteogeniche agli osteoclasti.
Per comprendere il coinvolgimento del trasferimento dei mitocondri mediato da MIRO1 nell’omeostasi dello scheletro, Ding e colleghi hanno valutato il fenotipo osseo del modello murino knock-out per MIRO1 nella linea osteogenica, riscontrando una riduzione della BMD (Bone Mineral Density), del BV/TV (Bone Volume/Total Volume), del numero e dello spessore delle trabecole con un incremento del numero degli osteoclasti, caratteristiche classiche di un fenotipo osteoporotico.
In sintesi, il funzionamento dei mitocondri nelle cellule osteogeniche è cruciale per la regolazione del differenziamento e dell’attività degli osteoclasti e disfunzioni in questo processo potrebbero essere coinvolte nell’eziopatogenesi di malattie ossee legate a un aumento del riassorbimento osseo, ponendo, in tal modo, le basi per l’identificazione di nuovi approcci terapeutici per patologie osteolitiche.
Commento a “Mitochondria from osteolineage cells regulate myeloid cell-mediated bone resorption” di Ding P, Gao C, Zhou J, Mei J, Li G, Liu D, Li H, Liao P, Yao M, Wang B, Lu Y, Peng X, Jiang C, Yin J, Huang Y, Zheng M, Gao Y, Zhang C, Gao J. Nat Commun. 2024 Jun 14;15(1):5094. doi: 10.1038/s41467-024-49159-3.
Referenze
1. Feng, X. & McDonald, J. M. Disorders of bone remodeling. Annu. Rev. Pathol. 6, 121–145 (2011).
2. Zheng, C. X., Sui, B. D., Qiu, X. Y., Hu, C. H. & Jin, Y. Mitochondrial Regulation of Stem Cells in Bone Homeostasis. Trends Mol. Med. 26, 89–104 (2020).
3. Park, D. et al. Endogenous bone marrow MSCs are dynamic, faterestricted participants in bone maintenance and regeneration. Cell Stem Cell 10, 259–272 (2012).
4. Ding, P. et al. Osteocytes regulate senescence of bone and bone marrow. Elife 11, (2022).
5. Karsenty, G. & Khosla, S. The crosstalk between bone remodeling and energy metabolism: a translational perspective. Cell Metab. 34, 805–817 (2022).
6. Yang, S., Feskanich, D., Willett, W. C., Eliassen, A. H. & Wu, T. Association between global biomarkers of oxidative stress and hip fracture in postmenopausal women: a prospective study. J. Bone Min. Res. 29, 2577–2583 (2014).
7. Jin, Z., Wei, W., Yang, M., Du, Y. & Wan, Y. Mitochondrial complex I activity suppresses inflammation and enhances bone resorption by shifting macrophage-osteoclast polarization. Cell Metab. 20, 483–498 (2014). 8. Langdahl, J. H. et al. Mitochondrial point mutation m.3243A>G associates with lower bone mineral density, thinner cortices, and reduced bone strength: a case-control study. J. Bone Min. Res. 32, 2041–2048 (2017).
9. Lopez-Domenech, G. et al. Miro proteins coordinate microtubuleand actin-dependent mitochondrial transport and distribution. EMBO J. 37, 321–336 (2018)