Le cellule staminali scheletriche (SSC) hanno la capacità di differenziare in osteoblasti, condrociti, adipociti e cellule stromali (1, 2). Sono caratterizzate dai marker di superficie Lin–PDPN+CD146–CD73+CD164+; le SSC derivanti da periostio (P-SSC) sono principalmente coinvolte nella riparazione delle fratture (3). Attraverso l’utilizzo di modelli murini sono stati identificati alcuni marcatori delle SSC [Prxx1 (Paired related homeobox 1), Osx (Osterix), Ctsk (Cathepsin K), acta2 (actin alpha 2), e PDGFRA (platelet derived growth factor receptor alpha)], che, purtroppo, non risultano specifici in quanto la loro espressione si riscontra anche in altre popolazioni cellulari o differenti lineage di SSC. L’identificazione di molecole più selettive per le SSC è necessaria per il loro isolamento al fine di poterle utilizzare nella rigenerazione tissutale per patologie muscoloscheletriche (4, 5).
Pertanto, il lavoro di Xing e colleghi, pubblicato su Journal of Clinical Investigation, è stato volto alla caratterizzazione sia in vitro che in vivo di un nuovo marker di superficie delle P-SSC.
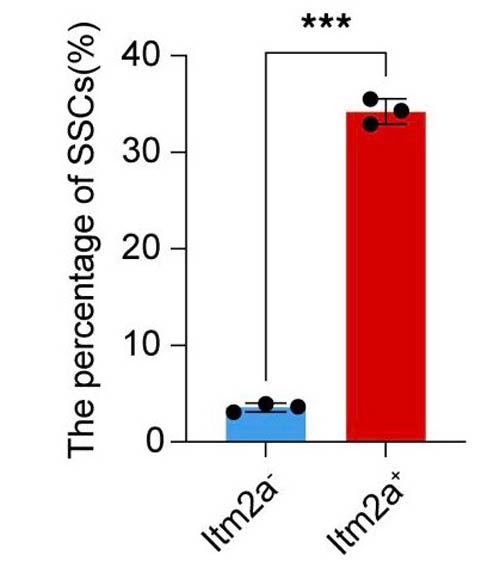
Per identificare nuovi markers di espressione, gli autori hanno effettuato un scRNA-seq di cellule periostali isolate da topi Prrx1-Cre, in quanto in precedenti lavori Prrx1 era stato considerato un marker delle P-SSC (6); le analisi bioinformatiche hanno permesso di identificare nella popolazione cellulare in esame differenti sottopopolazioni dei lineages degli osteoblasti, delle cellule muscolari e delle cellule endoteliali. L’analisi dell’RNA ha confermato che tra i geni più espressi nelle P-SSC vi fossero Prrx1 e Itm2a codificante la proteina integrale di membrana 2A. Saggi in vitro hanno dimostrato come le cellule ingegnerizzate overesprimenti Itm2a avessero una maggiore clonigenicità, una maggiore capacità differenziativa in condrociti, osteoblasti e adipociti e una maggiore capacità di formare osteoide rispetto alle cellule di controllo.
Con la generazione del modello murino transgenico Itm2a-Cre-mCherry, gli autori hanno potuto localizzare in vivo le cellule che esprimessero Itm2a, confermando la loro localizzazione periostale. Inoltre, gli autori hanno dimostrato che, in seguito a frattura, gli animali Itm2a transgenici presentino una maggiore capacità di generare osteoblasti, condrociti e cellule stromali e riparare più rapidamente il danno osseo rispetto agli animali wild-type. L’analisi trascrittomica ha rilevato come le cellule Itm2a coinvolte nella riparazione delle fratture esprimessero più elevati livelli di BMP (Bone Morphogenetic Protein) 2, proteina che svolge un ruolo chiave nello sviluppo scheletrico e nella riparazione delle fratture (7).
In conclusione, gli autori identificano Itm2A come nuovo marker di P-SSC. L’espressione di questo marcatore permetterà di isolare queste cellule in maniera più specifica e di utilizzarle nella terapia rigenerativa per patologie scheletriche. Inoltre, la caratterizzazione di questo nuovo marcatore ha permesso anche di identificare una popolazione staminale con un aumentato rate proliferativo, rappresentando un nuovo bersaglio terapeutico per le patologie scheletriche.
Commento a “Itm2a expression marks periosteal skeletal stem cells that contribute to bone fracture healing” di Xing W, Feng H, Jiang B, Gao B, Liu J, Xie Z, Zhang Y, Hu X, Sun J, Greenblatt M, Zhou BO, Zou W. J Clin Invest. 2024 Jan;134(17). doi: 10.1172/JCI176528.
Referenze
1. Bianco P. Bone and the hematopoietic niche: a tale of two stem cells. Blood. 2011;117(20):5281-8.
2. Sacchetti B, Funari A, Michienzi S, Di Cesare S, Piersanti S, Saggio I, et al. Self-renewing osteoprogenitors in bone marrow sinusoids can organize a hematopoietic microenvironment. Cell. 2007;131(2):324-36.
3. Thompson Z, Miclau T, Hu D, Helms JA. A model for intramembranous ossification during fracture healing. J Orthop Res. 2002;20(5):1091-8.
4. Colnot C. Skeletal cell fate decisions within periosteum and bone marrow during bone regeneration. J Bone Miner Res. 2009;24(2):274-82.
5. Kawanami A, Matsushita T, Chan YY, Murakami S. Mice expressing GFP and CreER in osteochondro progenitor cells in the periosteum. Biochem Biophys Res Commun. 2009;386(3):477-82.
6. Liu H, Li P, Zhang S, Xiang J, Yang R, Liu J, et al. Prrx1 marks stem cells for bone, white adipose tissue and dermis in adult mice. Nat Genet. 2022;54(12):1946-58.
7. Kwong FN, Hoyland JA, Freemont AJ, Evans CH. Altered relative expression of BMPs and BMP inhibitors in cartilaginous areas of human fractures progressing towards nonunion. J Orthop Res. 2009;27(6):752-7.