Commento al lavoro: Osteocyte-derived sclerostin impairs cognitive function during ageing and Alzheimer’s disease progression. Shi T, Shen S, Shi Y, Wang Q, Zhang G, Lin J, Chen J, Bai F, Zhang L, Wang Y, Gong W, Shao X, Chen G, Yan W, Chen X, Ma Y, Zheng L, Qin J, Lu K, Liu N, Xu Y, Shi YS, Jiang Q, Guo B. Nat Metab. 2024 Mar;6(3):531-549. doi: 10.1038/s42255-024-00989-x. Epub 2024 Feb 26. PMID: 38409606.
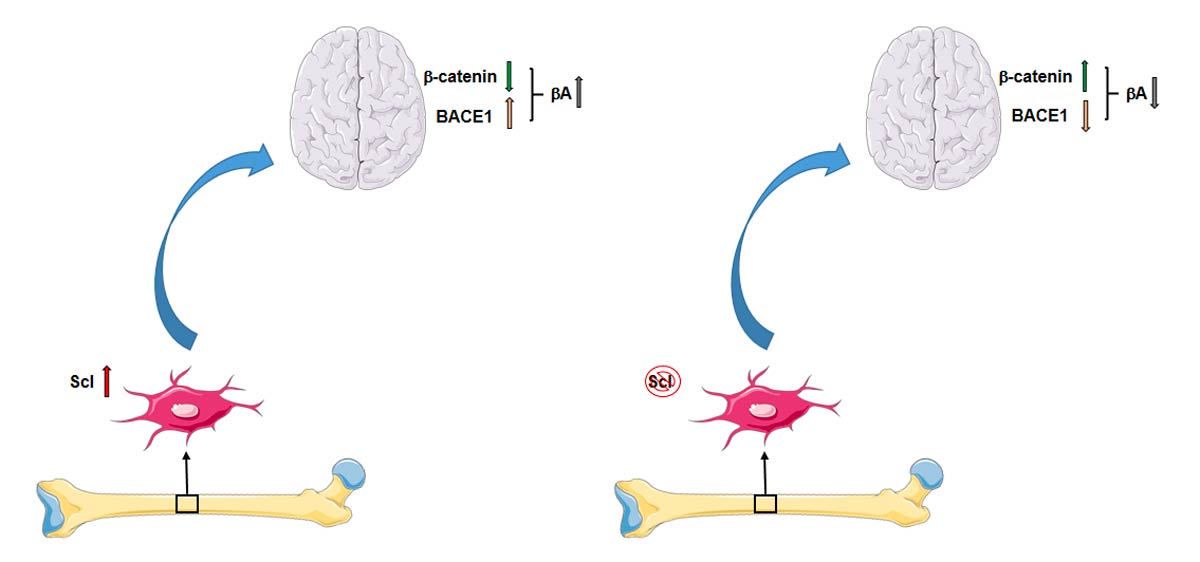
Molteplici studi hanno messo in evidenza come l’invecchiamento acceleri la comparsa di deficit cognitivi e di patologie neurodegenerative caratterizzate da una riduzione delle capacità di neurogenesi, della forza e della funzione sinaptica (1-4). Recentemente è stato dimostrato come l’osso possa fungere da organo endocrino secernendo numerosi fattori come osteocalcina, FGF23 e altre osteochine che possono giocare un ruolo chiave nello sviluppo e omeostasi del sistema nervoso (SN) (5-7). Sclerostina (Scl), antagonista della via di Wnt-b-catenin, prodotta dagli osteociti, gioca un ruolo chiave nella regolazione del metabolismo osseo (8) e sembra essere implicata nei processi di perdita di memoria che si verificano in quadri di AD attraverso l’inibizione della via di Wnt-b-catenin (9).
Lo studio di Shi et al. pubblicato su Nature Metabolism, attraverso l’utilizzo di modelli in vivo e di esperimenti di co-colture in vitro, ha dimostrato il ruolo chiave di Scl nell’insorgenza e progressione della malattia di Alzheimer.
In particolare gli autori attraverso l’utilizzo di vari modelli murini, come Scl-TG, Scl-KI, Scl-cKO e Scl-KO hanno dimostrato come l’osteochina prodotta dagli osteociti sia in grado di attraversare la barriera ematoencefalica e aumentare la produzione di placche b-amiloidi (bA) attraverso l’attivazione della via di segnalazione BACE1 (b-catenin-b-secretase1). Inoltre, lo studio evidenzia, che gli alti livelli sierici di Scl età-dipendente nei topi Scl-TG, Scl-KI inducono una riduzione dell’espressione di b-catenin con un incremento di BACE1 e in aggiunta si assiste ad una riduzione delle capacità cognitive. Al contrario, nei topi Scl-cKO e Scl-KO, caratterizzati da bassi livelli circolanti della proteina, si osserva un incremento di b-catenin con una contemporanea riduzione della secretasi-1 oltreché un miglioramento delle performance cognitive.
Il ricorso ad esperimenti in vitro con co-colture di MLO-Y4 e linea cellulare neuronale N2a (Neuro2a cells) hanno permesso di mimare e studiare i meccanismi alla base del cross-talk osso-cervello. Dopo 48 ore nella co-coltura si assiste all’aumento dell’espressione di BACE1, al contrario nelle co-colture trattate con Scl-Ab si osserva una riduzione di BACE1, fondamentale per la formazione delle placche b-amiloidi.
Gli autori, inoltre, nei pazienti con malattia di AD hanno riscontrato alti livelli sierici di Scl e tali livelli correlano negativamente con gli scores delle principali funzioni cognitive, confermando così i dati ottenuti sui modelli murini.
In conclusione lo studio mette in luce il ruolo cruciale del cross-talk osso-cervello ed in particolare il coinvolgimento di Scl, proteina coinvolta nel regolazione del metabolismo osseo, nella comprensione dei meccanismi alla base della malattia di AD e la individua come possibile target terapeutico.
- Piehl N, van Olst L, Ramakrishnan A, Teregulova V, Simonton B, Zhang Z, Tapp E, Channappa D, Oh H, Losada PM, Rutledge J, Trelle AN, Mormino EC, Elahi F, Galasko DR, Henderson VW, Wagner AD, Wyss-Coray T, Gate D. Cerebrospinal fluid immune dysregulation during healthy brain aging and cognitive impairment. Cell. 2022 Dec 22;185(26):5028-5039.e13. doi: 10.1016/j.cell.2022.11.019. Epub 2022 Dec 13. PMID: 36516855; PMCID: PMC9815831.
- Bellenguez C, Küçükali F, Jansen IE, Kleineidam L, Moreno-Grau S, Amin N, Naj AC, Campos-Martin R, Grenier-Boley B, Andrade V et al. New insights into the genetic etiology of Alzheimer’s disease and related dementias. Nat Genet. 2022 Apr;54(4):412-436. doi: 10.1038/s41588-022-01024-z. Epub 2022 Apr 4. PMID: 35379992; PMCID: PMC9005347.
- Villeda SA, Plambeck KE, Middeldorp J, Castellano JM, Mosher KI, Luo J, Smith LK, Bieri G, Lin K, Berdnik D, Wabl R, Udeochu J, Wheatley EG, Zou B, Simmons DA, Xie XS, Longo FM, Wyss-Coray T. Young blood reverses age-related impairments in cognitive function and synaptic plasticity in mice. Nat Med. 2014 Jun;20(6):659-63. doi: 10.1038/nm.3569. Epub 2014 May 4. PMID: 24793238; PMCID: PMC4224436.
- Sahay A, Scobie KN, Hill AS, O’Carroll CM, Kheirbek MA, Burghardt NS, Fenton AA, Dranovsky A, Hen R. Increasing adult hippocampal neurogenesis is sufficient to improve pattern separation. Nature. 2011 Apr 28;472(7344):466-70. doi: 10.1038/nature09817. Epub 2011 Apr 3. PMID: 21460835; PMCID: PMC3084370.
- Han Y, You X, Xing W, Zhang Z, Zou W. Paracrine and endocrine actions of bone-the functions of secretory proteins from osteoblasts, osteocytes, and osteoclasts. Bone Res. 2018 May 24;6:16. doi: 10.1038/s41413-018-0019-6. PMID: 29844945; PMCID: PMC5967329.
- ADHR Consortium. Autosomal dominant hypophosphataemic rickets is associated with mutations in FGF23. Nat Genet. 2000 Nov;26(3):345-8. doi: 10.1038/81664. PMID: 11062477.
- Oury F, Khrimian L, Denny CA, Gardin A, Chamouni A, Goeden N, Huang YY, Lee H, Srinivas P, Gao XB, Suyama S, Langer T, Mann JJ, Horvath TL, Bonnin A, Karsenty G. Maternal and offspring pools of osteocalcin influence brain development and functions. Cell. 2013 Sep 26;155(1):228-41. doi: 10.1016/j.cell.2013.08.042. PMID: 24074871; PMCID: PMC3864001.
- Poole KE, van Bezooijen RL, Loveridge N, Hamersma H, Papapoulos SE, Löwik CW, Reeve J. Sclerostin is a delayed secreted product of osteocytes that inhibits bone formation. FASEB J. 2005 Nov;19(13):1842-4. doi: 10.1096/fj.05-4221fje. Epub 2005 Aug 25. PMID: 16123173.
- Liu CC, Tsai CW, Deak F, Rogers J, Penuliar M, Sung YM, Maher JN, Fu Y, Li X, Xu H, Estus S, Hoe HS, Fryer JD, Kanekiyo T, Bu G. Deficiency in LRP6-mediated Wnt signaling contributes to synaptic abnormalities and amyloid pathology in Alzheimer’s disease. Neuron. 2014 Oct 1;84(1):63-77. doi: 10.1016/j.neuron.2014.08.048. Epub 2014 Sep 18. PMID: 25242217; PMCID: PMC4199382.