L’incremento del differenziamento e dell’attività degli osteoclasti contribuisce allo sviluppo dell’osteoporosi, patologia caratterizzata da uno sbilanciamento tra riassorbimento osseo e deposizione di nuova matrice mineralizzata. Per identificare nuovi approcci terapeutici per tale patologia, è necessario caratterizzare i meccanismi molecolari che controllano l’osteoclastogenesi, che avviene a partire da precursori mononucleati della linea mieloide attraverso un processo altamente regolato che coinvolge fattori di trascrizione e segnali extracellulari.
Il lavoro di Hansen e colleghi, pubblicato su Bone Research, si è posto l’obiettivo di caratterizzare la regolazione trascrizionale durante il processo di osteoclastogenesi per identificare dei nuovi regolatori che influenzano il differenziamento e l’attività degli osteoclasti utilizzando tecniche avanzate di profilazione genetica.
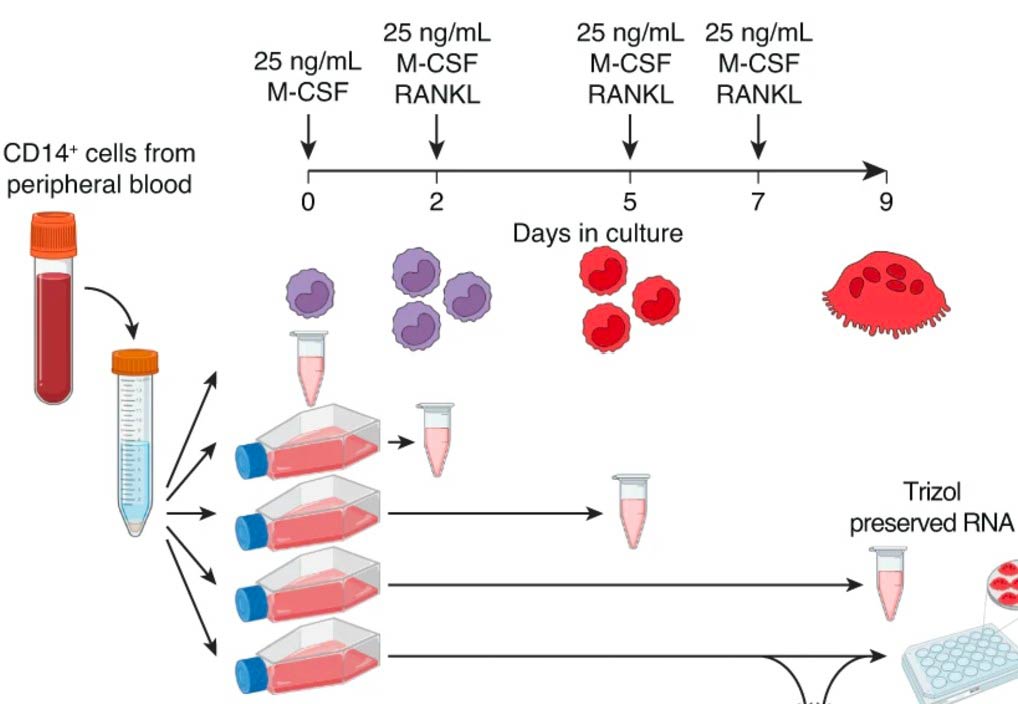
Monociti CD14+ sono stati isolati da sangue periferico di 8 donne con età tra 18-49 anni e sono stati indotti a differenziare in osteoclasti per 9 giorni; l’RNA è stato estratto al tempo 0, e dopo 2, 5 e 9 g (giorni) di trattamento con la citochina osteoclastogenica RANK-L (Receptor Activator of Nuclear Factor κ B Ligand). I campioni sono stati sottoposti ad analisi RNA-seq che ha evidenziato notevoli cambiamenti trascrizionali che supportano la maturazione dei precursori in osteoclasti funzionali; infatti, è stata riscontrata una downregolazione dell’espressione di geni regolatori dei monociti (TREM1, SELL e CLEC10A) e la contemporanea upregolazione di trascritti essenziali per gli osteoclasti (CTSK, ACP5, MMP9 e CA2). Gli autori hanno rilevato la modulazione di 8980 geni durante il differenziamento, identificando nuovi fattori che influenzano l’osteoclastogenesi e l’attività degli osteoclasti, ed evidenziando, in tal modo, che il controllo trascrizionale degli osteoclasti è più complesso di quanto precedentemente compreso.
Con l’obiettivo di identificare un nuovo trattamento per l’osteoporosi, gli autori hanno focalizzato l’attenzione sul ruolo dei recettori GPCR (G-protein coupled receptor) nella regolazione trascrizionale del differenziamento osteoclastico; tali proteine svolgono un ruolo chiave nell’attività di rimodellamento osseo e rappresentano target di alcuni farmaci già approvati dalla FDA per ipertensione polmonare, schizzofrenia, ma anche iperparatiroidismo e osteoporosi (1). Tra i recettori GPCR modulati durante l’osteoclastogenesi, gli autori hanno individuato LGR4, un recettore di RANK-L (2), e GIPR (Gastric Inhibitory Polypeptide Receptor) che è il recettore dell’incretina, entrambe già noti per inibire il differenziamento e l’attività degli osteoclasti (3). Inoltre, Hansen et al. hanno caratterizzato il ruolo di altri 3 recettori GPCR negli osteoclasti: C5AR1 (complement 5a receptor 1), SSTR2 (somatostatin receptor 2) e FFAR4 (free fatty acid receptor 4/GPR120). C5AR1 stimola la formazione degli osteoclasti, mentre SSTR2 e FFAR4 riducono il differenziamento e l’attività di tali cellule.
L’articolo esplora i cambiamenti trascrizionali durante il differenziamento degli osteoclasti e identifica C5AR1, SSTR2 e FFAR4 come nuovi regolatori dell’attività osteoclastica ponendo le basi per lo sviluppo di terapie mirate per malattie ossee come l’osteoporosi.
Commento a “Transcriptional reprogramming during osteoclast differentiation identifies regulators of osteoclast activity” di Hansen M, Madsen K, Price M, Soe K, Omata Y, Zaiss MM, Gorvin CM, Frost M, Rauch A. Bone Research. 2024 Jan;12(5). doi: 10.1038/s41413-023-00312-6.
Referenze
1. Hauser, A. S. Trends in GPCR drug discovery: new agents, targets and indications. Nat Rev Drug Discov. 16(12)829-842 (2017).
2. Luo, J. et al. LGR4 is a receptor for RANKL and negatively regulates osteoclast differentiation and bone resorption. Nat. Med. 22, 539–546 (2016).
3. Hansen, M. S. et al. GIP reduces osteoclast activity and improves osteoblast survival in primary human bone cells. Eur. J. Endocrinol. 188, lvac004 (2023).