Il tessuto osseo svolge importanti funzioni endocrine ed è in grado di interagire, sia in condizioni fisiologiche che patologiche, con gli altri organi del corpo (1).
La comunicazione tra l’osso e un altro organo può avvenire attraverso il rilascio di ormoni, di citochine oppure attraverso le vescicole extracellulari (EV), cioè piccole particelle eterogenee, prodotte da qualsiasi tipologia cellulare, che hanno la capacità di veicolare proteine, acidi nucleici o interi organelli. Queste particelle possono legarsi alla membrana cellulare oppure possono essere interamente internalizzate e veicolare così il loro contenuto nella cellula bersaglio (2-4).
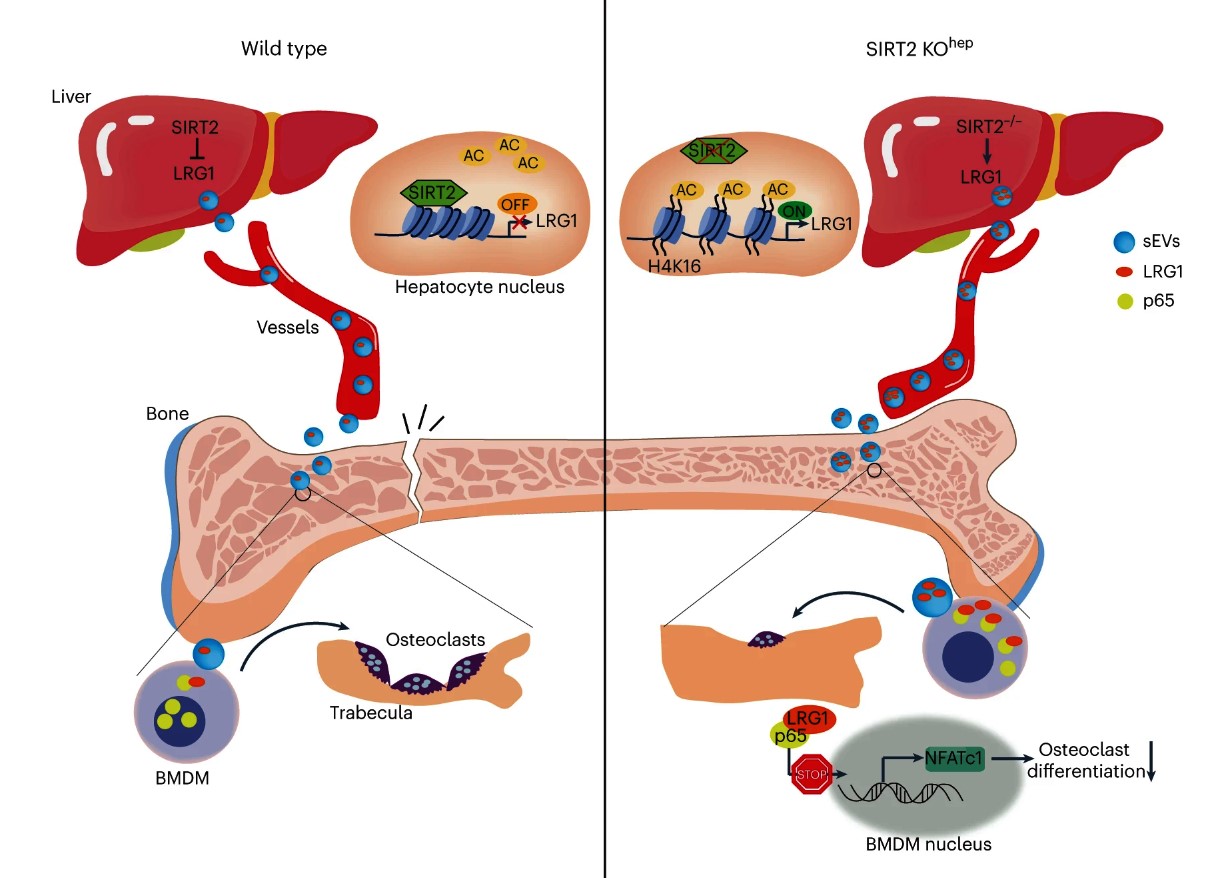
Nel lavoro pubblicato lo scorso Maggio su Nature Metabolism, Lin e co-autori studiano l’interazione tra fegato e tessuto osseo mediata dalle EV. In particolare, in tale studio si caratterizza il ruolo della proteina SIRT2 (Sirtuina deacetilasi 2 NAD-dipendente) nel rimodellamento osseo e nell’osteoporosi. In un lavoro pubblicato precedentemente, He et al. hanno evidenziato come tale proteina sia espressa nel fegato e sia coinvolta in processi quali l’invecchiamento cellulare (5).
Dopo aver dimostrato che i livelli della proteina SIRT2 aumentino nel fegato di topi con osteoporosi senile, Lin e co-autori generano un modello SIRT2-knock out condizionale negli epatociti (SIRT2-KOhep). Tale modello murino presenta un incremento del BV/TV e del Th.N, una riduzione del numero di osteoclasti e dei livelli circolanti di CTX.
Per comprendere il meccanismo molecolare alla base della comunicazione fegato-osso mediata da SIRT2 nell’osteoporosi, Lin et al. valutano il potenziale osteoblastogenico e osteoclastogenico del plasma isolato da animali SIRT2-KOhep in esperimenti in vitro utilizzando cellule midollari (BMM). Il plasma isolato dai topi SIRT2-KOhep è in grado di compromettere esclusivamente la formazione degli osteoclasti. Non avendo riscontrato difetti nel metabolismo della vitamina D, che avviene inizialmente nel fegato, gli autori si concentrano sul ruolo delle EV contenute nel plasma dei topi SIRT2-KOhep. Dopo aver isolato le EV dal plasma di animali SIRT2-KOhep e animali di controllo e aver dimostrato che non ci sono differenze nel numero, nelle dimensioni e nella capacità di essere internalizzate da parte delle cellule ossee, gli autori dimostrano come le vescicole di topi SIRT2-KOhep siano in grado di inibire il differenziamento delle BMM in osteoclasti.
Poiché le EV veicolano il loro cargo all’interno delle cellule bersaglio, Lin e co-autori analizzano il contenuto proteico degli epatociti SIRT2-KO e delle relative cellule di controllo. Negli animali SIRT2-KOhep, attraverso spettrometria di massa, gli autori riscontrano un incremento sia nel fegato che a livello plasmatico di LRG1 (Alpha-2 glicoproteina 1 ricca in leucina) una glicoproteina secretoria coinvolta nella comunicazione cellulare. A livello plasmatico, la maggior parte della glicoproteina è contenuta e veicolata nelle EV.
Inoltre, gli autori hanno caratterizzato l’effetto della riduzione di SIRT2 in un’altra condizione che determina perdita di massa ossea come la riduzione di estrogeni, analizzando topi femmine ovariectomizzate (OVX-SIRT2 KOhep); è stato dimostrato, anche in questo caso, come la perdita di massa ossea causata da ovariectomia determini un aumento della proteina LRG1 a livello epatico e nelle EV. Per comprendere se l’incremento epatico di LRG1 sia correlato all’effetto protettivo dalla perdita di massa ossea riscontrata nei topi OVX-SIRT2-KOhep, in tali animali è stato inoculato un vettore in grado di ridurre l’espressione di LRG1. La riduzione di tale proteina annulla l’effetto protettivo determinato dall’ablazione di SIRT2 negli epatociti, confermando che l’aumento di massa ossea nei topi SIRT2-KOhep è una conseguenza dell’incremento di espressione di LRG1 negli epatociti.
Per valutare un possibile ruolo traslazione della comunicazione fegato-osso, gli autori testano AGK2, un inibitore specifico di SIRT2, come possibile molecola per prevenire o trattare l’osteoporosi. L’iniezione intraperitoneale di AGK2 per 6 settimane in topi OVX-wild-type determina una condizione simile a quella dell’ablazione di SIRT2 negli epatociti, ossia un incremento della BV/TV e dell’architettura trabecolare e un aumento di LRG1 sia negli epatociti che nelle EV circolanti.
Gli autori presentano un nuovo modello di interazione tra fegato e osso che coinvolge le vescicole extracellulari e propongono anche l’asse SIRT2-EV-LRG1 come possibile pathway da utilizzare come target terapeutico per prevenire l’osteoporosi.
Commento a “SIRT2 regulates extracellular vesicle-mediated liver-bone communication” di Lin L, Guo Z, He E, Long X, Wang D, Zhang Y, Guo W, Wei Q, He W, Wu W, Li J, Wo L, Hong D, Zheng J, He M, Zhao Q. Nature Metabolism (2023) May;5(5):821-841. doi: 10.1038/s42255-023-00803-0.
Referenze
1. Zaidi M, Kim SM, Mathew M, Korkmaz F, Sultana F, Miyashita S, et al. Bone circuitry and interorgan skeletal crosstalk. Elife. 2023;12.
2. Doyle LM, Wang MZ. Overview of Extracellular Vesicles, Their Origin, Composition, Purpose, and Methods for Exosome Isolation and Analysis. Cells. 2019;8(7).
3. Huang X, Lan Y, Shen J, Chen Z, Xie Z. Extracellular Vesicles in Bone Homeostasis: Emerging Mediators of Osteoimmune Interactions and Promising Therapeutic Targets. Int J Biol Sci. 2022;18(10):4088-100.
4. Li Y, Yin P, Guo Z, Lv H, Deng Y, Chen M, et al. Bone-Derived Extracellular Vesicles: Novel Players of Interorgan Crosstalk. Front Endocrinol (Lausanne). 2019;10:846.
5. He M, Chiang HH, Luo H, Zheng Z, Qiao Q, Wang L, et al. An Acetylation Switch of the NLRP3 Inflammasome Regulates Aging-Associated Chronic Inflammation and Insulin Resistance. Cell Metab. 2020;31(3):580-91 e5.