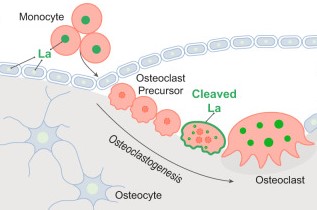
Nel rimodellamento osseo, gli osteoclasti (OC), cellule giganti multinucleate che originano dalla fusione di precursori monocitari (pOC), svolgono un ruolo fondamentale nel mantenimento della struttura e della funzionalità del tessuto osseo (1). I meccanismi alla base della fusione dei pOC in condizioni fisiologiche e le alterazioni che possono determinare l’insorgenza di condizioni patologiche, non sono ancora del tutto noti (2-4).
Nel lavoro pubblicato su Nature Communications, Whitlock e coautori hanno identificato un ruolo chiave della proteina “La” nella fusione dei pOC. La proteina “La”, conosciuta anche come LARP3 (cancer-associated RNA-binding protein La) e codificata dal gene SSB, espressa ad elevati livelli e in modo ubiquitario da tutte le cellule, è nota per il suo ruolo di RNA-binding nel nucleo e di proteina-chaperone nel citoplasma (5). In seguito ad alcuni tagli proteolitici, tale proteina può perdere l’intera sequenza amminoacidica a partire dalla posizione 376 che ne determina la localizzazione nucleo/citoplasmatica, e localizzarsi sulla superficie cellulare. La funzione biologica della forma clivata di La era finora sconosciuta.
Valutando i cambiamenti di espressione genica durante il differenziamento da monociti a OC maturi, gli autori identificano modulazioni drastiche dell’espressione della proteina La durante il differenziamento degli osteoclasti; infatti osservano come essa non sia espressa nel passaggio da monociti a pOC (monociti trattati solo con il fattore di crescita delle colonie monocitarie, M-CSF) mentre, tramite spettrometria di massa, la riscontrano negli osteoclasti maturi. Inoltre, oltre a tali variazioni dell’espressione durante il processo di osteoclastogenesi, gli autori evidenziano anche alterazioni della struttura e localizzazione della proteina. Infatti, la forma nucleare/citoplasmatica espressa dai monociti, scompare completamente nei precursori degli osteoclasti, mentre negli osteoclasti maturi si riscontra come proteina di membrana; tali effetti sono dipendenti dall’azione della principale citochina osteoclastogenica RANKL.
Gli autori ipotizzano quindi che il ruolo di “La” nella fusione degli OC sia separata dalla sua funzione “canonica” del metabolismo dell’RNA, e suggeriscono una diversa funzione di questa proteina a seconda della sua localizzazione. Inoltre, la proteina “La” clivata ha la capacità di aumentare anche l’attività di riassorbimento degli osteoclasti, come dimostrato da esperimenti di overespressione della proteina clivata rispetto alla proteina totale e da esperimenti di silenziamento genico.
Per comprendere il coinvolgimento di “La” in patologie ossee, gli autori hanno utilizzato un modello murino di displasia fibrosa (FD), patologia caratterizzata da un incremento dell’osteoclastogenesi. Dati ottenuti in colture di osteoclasti da cellule di midollo isolate dal modello murino di FD, evidenziano come il trattamento con un anticorpo anti-La sia in grado di ridurre il differenziamento degli osteoclasti.
Il lavoro pubblicato su Nature Communications, dimostra come “La” possa essere considerata una nuova molecola coinvolta nel differenziamentoma è da approfondire il ruolo nel riassorbimento osseo. Il meccanismo di azione descritto identifica una funzione associata alla struttura e alla localizzazione “non canonica” della proteina “La”. Il lavoro inoltre suggerisce che una riduzione della forma di membrana di tale proteina possa essere un nuovo approccio curativo per patologie caratterizzate da elevata osteoclastogenesi come la displasia fibrosa.
Commento a “Cell surface-bound La protein regulates the cell fusion stage of osteoclastogenesis” di J. Whitlock, E. Leikina, K. Melikov, LF. De Castro, S. Mattijsen, R.J. Maraia, MT Collins and LV Chernomordik. Nature Communications (2023) 14:616. doi: 10.1038/s41467-023-36168-x.
References
1. Boyce BF, Rosenberg E, de Papp AE, Duong LT. The osteoclast, bone remodelling and treatment of metabolic bone disease. Eur J Clin Invest. 2012;42(12):1332-41.
2. Soe K. Osteoclast Fusion: Physiological Regulation of Multinucleation through Heterogeneity-Potential Implications for Drug Sensitivity. Int J Mol Sci. 2020;21(20).
3. Verma SK, Leikina E, Melikov K, Gebert C, Kram V, Young MF, et al. Cell-surface phosphatidylserine regulates osteoclast precursor fusion. J Biol Chem. 2018;293(1):254-70.
4. Xing L, Xiu Y, Boyce BF. Osteoclast fusion and regulation by RANKL-dependent and independent factors. World J Orthop. 2012;3(12):212-22.
5. Kuehnert J, Sommer G, Zierk AW, Fedarovich A, Brock A, Fedarovich D, et al. Novel RNA chaperone domain of RNA-binding protein La is regulated by AKT phosphorylation. Nucleic Acids Res. 2015;43(1):581-94.